Neue Arzneimittel auf dem AMNOG-Prüfstand
Was bringt die Nutzenbewertung für Patienten?
Seit 2011 werden neue Arzneimittel in Deutschland nach der Zulassung auf ihren Zusatznutzen überprüft. Welche Vorteile bringt das gesetzlich vorgeschriebene Verfahren für Patientinnen und Patienten? Und was ist noch zu verbessern?
Damit ein neues Medikament eine behördliche Zulassung erhält, reicht es völlig aus, wenn der Hersteller nachweist, dass seine Neuerung besser wirkt als ein Placebo (Scheinmedikament). Alternativ genügt auch der Nachweis, dass es nicht schlechter wirkt als ein bereits für die gleiche Krankheit zugelassenes anderes Arzneimittel.1
Bislang erstatteten die Krankenkassen alle neuen Medikamente und das zu dem Preis, den der Hersteller verlangte – egal, ob die Neuheit nun tatsächlich besser war oder nicht. Damit ist seit 2011 Schluss. Denn da trat dasArzneimittelmarktneuordnungsgesetz – ein wahres Wortungetüm – in Kraft. Bekannter ist es unter seinem Kürzel „AMNOG“. Dahinter steckt ein verbraucherfreundlicher Gedanke: Nur wenn ein neues Mittel den Patienten einen zusätzlichen Nutzen gegenüber etablierten Therapien bringt, darf es auch mehr kosten.
Ein solcher Zusatznutzen wird nicht anhand theoretischer Vorteile ermittelt – wie besserer Laborwerte –, sondern anhand spürbarer gesundheitlicher Verbesserungen. Nur dann darf das neue Mittel auch mehr kosten. Wird kein Zusatznutzen festgestellt, ändert das zwar nichts an der Zulassung, aber der pharmazeutische Hersteller kann für das Medikament nicht mehr jeden Fantasiepreis verlangen.
Ein Blick zurück: Weil Preiskontrollen für neue Arzneimittel fehlten, war Deutschland jahrzehntelang ein Paradies für die Pharmaindustrie. Und sie konnte nicht nur hierzulande jede Menge Geld verdienen. Die hohen deutschen Preise dienten auch als Orientierung für andere Länder (Referenzpreis), die schon längst die Erstattungspreise für neue Arzneimittel staatlicherseits festlegen. Dank AMNOG enden diese paradiesischen Zustände für die pharmazeutische Industrie in Deutschland – zum Nutzen der Solidargemeinschaft aller Versicherten.
Kritik von allen Seiten
Als zahnloser Tiger verspottet oder als Bedrohung für den Pharmastandort Deutschland gebrandmarkt, erfährt das neue Verfahren zur frühen Nutzenbewertung von Arzneimitteln viel Kritik: Während die Arzneimittelhersteller es als viel zu streng beklagen, meinen manche, das Verfahren sei noch zu lasch, die Methodik führe immer noch zu einer ungerechtfertigt günstigen Einschätzung neuer Arzneimittel. Dem entgegnen die Befürworter der Nutzenbewertung, sie stelle eine grundlegende Veränderung dar, da zum ersten Mal in Deutschland eine staatlich eingeleitete Prüfung klarmache, dass so manche als Innovation bezeichnete Neuerung keine Vorteile für die Patienten bringe – trotz der Zulassung durch die Bundesbehörden.
Dass die Bewertung nach Vorgaben des AMNOG schon dazu geführt hat, dass das eine oder andere neue Arzneimittel ohne Zusatznutzen in Deutschland – im Gegensatz zu anderen Ländern – gar nicht erst auf den Markt kam, ist keineswegs zum Schaden für Patienten (GPSP 6/2011, S. 10).
Die Guten ins Töpfchen
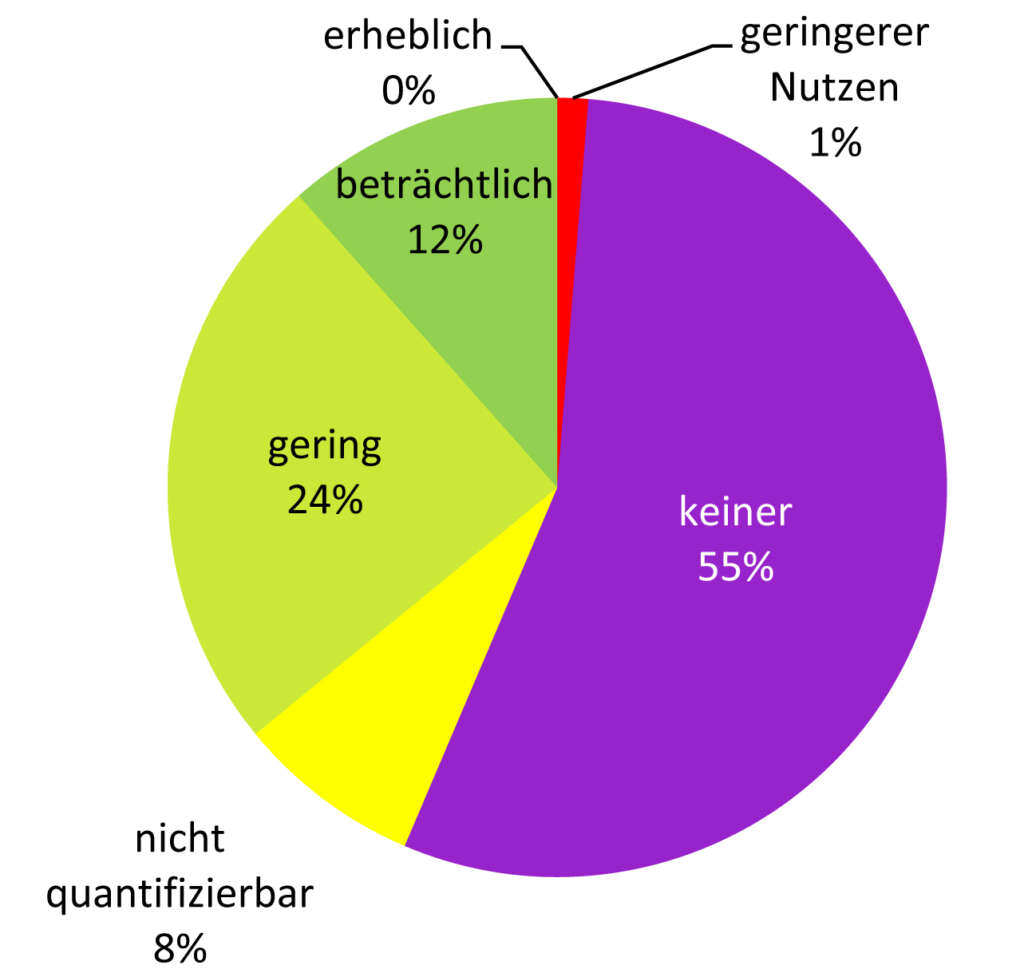
Bislang wurden vom G-BA (siehe Kasten) 50 Medikamente bewertet. Da einige mehr als ein Anwendungsgebiet haben, gab es insgesamt 78 Bewertungen.5 Jede zweite Bewertung (55%, siehe Grafik) kam zu dem Urteil: nicht besser als ältere Medikamente. Jede vierte (24%) erkannte einen geringen Zusatznutzen, und nur jeder achten Anwendung (12%) wurde ein beträchtlicher Zusatznutzen bescheinigt. Das beste Urteil erheblicher Zusatznutzen wurde kein einziges Mal vergeben. Dafür wurde bei einem Medikament (dem Krebsmittel Eribulin, Halaven®) festgestellt, dass es bei bestimmten Erkrankungen sogar schlechter abschneidet als die bisherige Therapie.
Ist das neue Mittel nicht besser als die vom G-BA festgelegte etablierte Therapie, darf es auch nicht mehr kosten als diese. Hat der G-BA einen Zusatznutzen festgestellt, verhandelt der Spitzenverband der gesetzlichen Krankenkassen mit dem pharmazeutischen Hersteller über den Preis des Arzneimittels, also die Erstattungshöhe.
Verbesserungen nötig
Doch der Teufel lauert wie immer im Detail. Das Verfahren hat noch Mängel. Das liegt zum Teil an Webfehlern im Gesetz. So können bereits geringere unerwünschte Wirkungen ausreichen, einem Medikament einen Zusatznutzen zu bescheinigen. Das ist in Ordnung, wenn auf der Nutzenseite nachgewiesen ist, dass das Mittel den Patienten wirklich hilft. Aber manchmal ist das nicht der Fall, etwa bei der Wirkstoffgruppe der Gliptine, die bei Diabetes Typ 2 eingesetzt werden. Diese neuen Mittel senken zwar den Blutzuckerspiegel, aber ob sie wirklich die bedrohlichen Komplikationen der Zuckerkrankheit wie Herzinfarkt oder Erblindung eindämmen, haben die Hersteller bislang nicht belegt (siehe auch Kasten Saxagliptin, S. 12). Damit unterscheiden sich die neuen Mittel wesentlich von den Standardmedikamenten Metformin und Sulfonylharnstoffen, für die diese so wichtigen Vorteile beschrieben sind.
Der G-BA hat im aktuellen Bewertungsverfahren zwei Gliptinen einen Zusatznutzen wegen geringerer unerwünschter Wirkungen bescheinigt (sie könnten weniger Unterzuckerungen verursachen) – obwohl Vorteile für Patienten nicht belegt sind. Der gegenwärtige Gesetzestext des AMNOG verlangt es so. Hier ist der neue Bundestag aufgefordert, für Klarheit zu sorgen.
 Sonderfall Krebs
Sonderfall Krebs
Besonders schwer zu bemessen ist das Nutzen-Schaden-Verhältnis bei Medikamenten zur Behandlung lebensbedrohlicher Erkrankungen wie Krebs. Bisher werden in Studien, auf denen die behördliche Zulassung der Krebsmittel basiert, die Auswirkungen des Arzneimittels auf die Lebensqualität meist nicht erfasst. Obwohl dies für die Betroffenen doch so wichtig ist. Neue Krebsmedikamente verlängern oft die Überlebenszeit nur um wenige Wochen, haben aber häufig sehr schwere Schadwirkungen. Da kann das Prädikat „Zusatznutzen“ für wenige Wochen längeres Überleben dann schon zynisch wirken.
Was ich nicht weiß ….
Die Anforderungen des AMNOG, wie ein Zusatznutzen abzusichern ist, sind zu lasch. So reichen bereits „Anhaltspunkte“ für die Bescheinigung eines Zusatznutzens aus. Von Anhaltspunkten ist die Rede, wenn nur eine kleine oder vorläufige Studie auf einen möglichen Vorteil hinweist. Das ist zu vage, um wirklich von einem echten Nutzen für Patienten ausgehen zu können.
Ein grundsätzliches Problem jeder Nutzenbewertung kurz nach der Zulassung ist, dass unerwünschte Wirkungen von Arzneimitteln automatisch zu wenig in die Bewertung des neuen Wirkstoffs einfließen, da sie zu diesem Zeitpunkt noch zu wenig bekannt sind. Die typischen Zulassungsstudien sind zu klein und von zu kurzer Dauer, um das Potenzial ungünstiger Wirkungen zuverlässig einschätzen zu können. Die möglichen Risiken von Arzneimitteln, die bereits jahrelang verwendet werden, sind wesentlich besser überschaubar und genauer bekannt. Die Bewertung der Risiken neuer Mittel wird also regelmäßig zu günstig ausfallen.
Lücke bei den „Waisen“
Eine Paradoxie hat das AMNOG auch zu bieten. Bei Medikamenten gegen seltene Krankheiten (Waisenmedikamente, Orphan Drugs) gilt laut Gesetz der Zusatznutzen durch die Zulassung als belegt. Das gilt aber nur so lange, wie der zu erwartende Umsatz eines solchen Medikaments weniger als 50 Millionen € beträgt. Wird diese Schwelle überschritten, muss der Nutzen durch den G-BA doch bewertet werden.
Fazit und Ausblick
Derzeit ist nur ein Zwischenfazit möglich: Deutschland ist mit dem AMNOG auf einem guten Weg, Patientinnen und Patienten vor schlechten neuen Arzneimitteln zu schützen – und davon gab es in den vergangenen Jahrzehnten zu viele. Schon jetzt bewahrt es uns vor unsinnig hohen Preisen für neue Medikamente, die einzig für den Hersteller einen Zusatznutzen haben – nämlich mehr Geld in seine Kassen zu spülen. Nun muss die Nutzenbewertung diesem Weg treu bleiben. Lücken im Gesetz müssen geschlossen und die Bewertungsmethoden nach und nach verfeinert werden. Bedenklich sind aktuelle Bestrebungen der Politik, die gerade angelaufene Nutzenbewertung für ältere Medikamente wieder abzuschaffen. Stattdessen soll die Pharmaindustrie weiterhin einen Rabatt auf patentgeschützte Mittel geben. Dieser Ablasshandel ginge aber auf Kosten der Patienten. Denn so würde nicht mehr untersucht, ob diese Arzneimittel einen (Zusatz-)Nutzen bringen.
Stand: 1. Dezember 2013 – Gute Pillen – Schlechte Pillen 06/2013 / S.10
